编者按
肥胖是由体内脂肪积聚过多而致,并由脂肪细胞的数量和大小决定。脂肪细胞主要分为两类:负责储藏能量的白色脂肪细胞和负责产热的棕色脂肪细胞(棕色脂肪细胞又分为典型棕色脂肪细胞和米色脂肪细胞)。通过激活棕色脂肪细胞产热,提高机体能耗,已成为治疗肥胖及代谢相关疾病的研究热点。
组蛋白去乙酰化酶(HDACs)可以从组蛋白或非组蛋白底物中去除乙酰基团,广泛参与了多种生物过程,其中就包括参与棕色和米色脂肪生理功能的调控。但HDACs调节脂肪细胞产热的机制尚不明确。
2021年6月,复旦大学代谢分子医学教育部重点实验室PI、基础医学院生物化学与分子生物学系潘东宁研究员课题组在Advanced Science (IF 15.804) 杂志上在线发表题为“PWWP2B Fine-Tunes Adipose Thermogenesis by Stabilizing HDACs in a NuRD Subcomplex”的研究成果,该研究利用蛋白质组学技术探究了组蛋白去乙酰化酶调节脂肪细胞产热的分子机制。中科新生命提供了蛋白组学技术支持。

【研究材料】
小鼠、脂肪组织和脂肪细胞
【技术方法】
蛋白质组学、免疫共沉淀、QPCR、免疫荧光染色、染色质免疫共沉淀等
【方法流程】

研究结果
1. PWWP2B蛋白在棕色和米色脂肪组织中富集
研究发现PWWP2B与核小体结合,将相关的染色质修饰酶招募到目标位点。研究人员利用转录组、QPCR和WB实验,首次揭示PWWP2B在小鼠脂肪中的表达分布。PWWP2B在棕色脂肪组织(BAT)的水平显著高于米色脂肪组织(WAT),包括附睾WAT(eWAT)和腹股沟WAT(eWAT)。PWWP2B表达水平随着棕色脂肪细胞分化递增(图1a和1b),冷诱导和激动剂Cl316243(一种有效的脂肪细胞脂解刺激剂,可增加棕色脂肪组织的生热作用和代谢率)处理均提高PWWP2B水平 (图1c-1f)。综上,PWWP2B在脂肪组织中富集且受条件诱导表达。
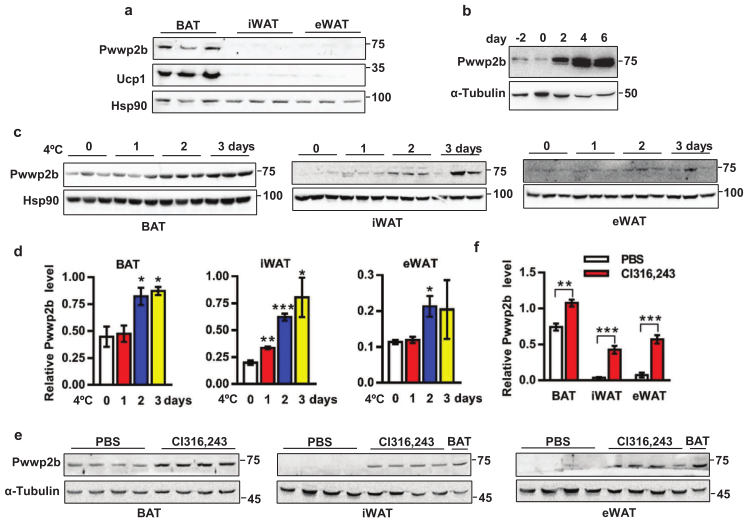
PWWP2B蛋白在脂肪组织中的表达
2. PWWP2B缺失可增强适应性产热和白色脂肪褐变
为研究PWWP2B在脂肪组织中的功能,作者构建了PWWP2B基因敲除小鼠模型 (Ad-KO),发现Ad-KO小鼠分离的BAT和BAT细胞中PWWP2B蛋白减少(图2a),产热标志蛋白Ucp1、Cidea、Prdm16、Cox8b和Pgc1α显著上调(图2b-2d),Ad-KO小鼠背部表面温度升高(图2e,2f)。激动剂Cl316243处理的Ad-KO小鼠 iWAT和eWAT脂肪细胞表达更多的褐化蛋白UCP1(图2g-2i),氧耗率也更高(图2j)。综上,PWWP2B在脂肪组织中增强适应性产热,调控白色脂肪褐变。
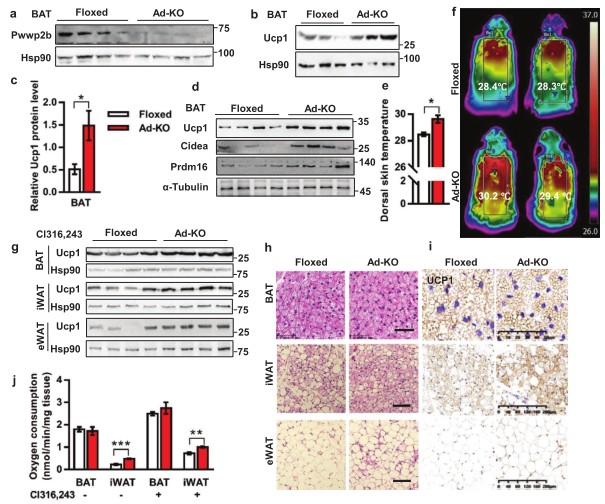
PWWP2B敲除增强适应性产热
3. PWWP2B缺失改善饮食诱导的肥胖
为了研究脂肪组织中PWWP2B缺失是否会改变全身的能量消耗,研究人员用高脂饮食(HFD)诱导Ad-KO小鼠,发现Ad-KO小鼠的体重增加的更慢,原因是脂肪含量减少(图3a,3b),Ad-KO小鼠产热量和夜间耗氧量增加,呼吸交换率降低 (图3c-3f),且改善了葡萄糖耐量和胰岛素敏感性(图3g,3h)。Ad-KO小鼠的BAT和iWAT中的脂滴大小显著减小,肝脏中的空泡也较少(图3i,3j)。Ad-KO小鼠的BAT中Ucp1蛋白和mRNA水平增加(图3k,3l)。胰岛素信号在脂肪组织和肝脏中得到改善 (图3m,3n),冷诱导Ad-KO小鼠有较高的核心温度(图3o)。综上,PWWP2B在棕色和米色脂肪细胞中都是负调控因子。
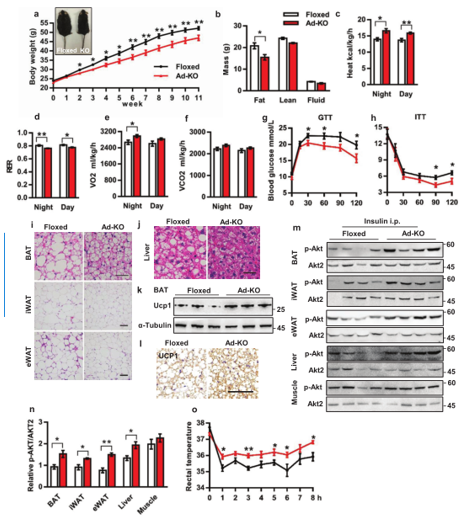
高脂饮食对Ad-KO小鼠的影响
4. PWWP2B抑制产热程序是脂肪细胞自主的
为了探讨PWWP2B对产热过程的抑制作用是否是细胞自主的,研究人员构建了PWWP2B敲除的永生化棕色前体脂肪细胞模型,并利用Western blot证实构建的准确性 (图4a)。PWWP2B敲除细胞中产热基因Ucp1, Prdm16, Pgc1α和Cox8b的表达水平显著增加(图4b-4d),与Ad-KO小鼠中产热基因变化一致(图4e,4f)。为了补充PWWP2B的功能,研究人员又在成熟的棕色脂肪细胞进行了重复实验,也得到相同的结果(图4g-4j)。综上,PWWP2B是脂肪细胞产热的分子制动器,避免过度活跃产热和适当维持能量稳态。
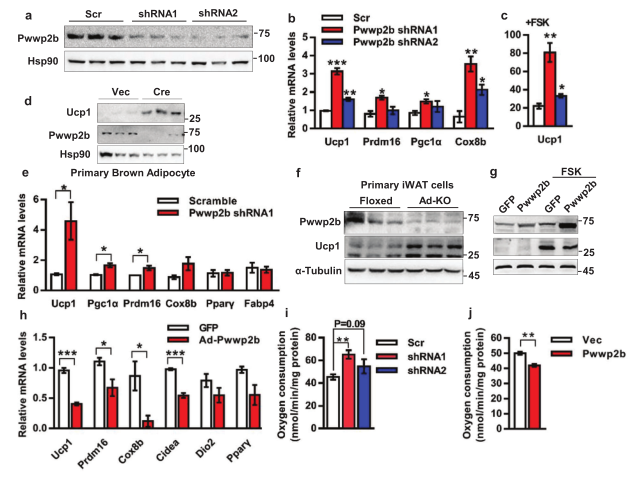
PWWP2B自主抑制产热
5. PWWP2B稳定NURD复合体中的HDAC1
为了阐明PWWP2B缺失能够激活脂肪细胞产热的机制,研究人员利用免疫沉淀和LC-MS/MS等技术,证实PWWP2B蛋白存在于棕色脂肪细胞核及产热基因Ucp1, Pgc1α和 Cox8b的启动子区域(图5b),且PWWP2B和HDAC1/2/3互作(图5c,5d)。在成熟的棕色脂肪细胞中过表达PWWP2B增加HDAC1的蛋白水平,而在原代米色脂肪细胞中PWWP2B缺失显著降低了HDAC1蛋白的表达 (图5e-5g)。泛素化实验表明PWWP2B通过降低HDAC1泛素化水平来稳定HDAC1(图5h,5i)。综上,PWWP2B通过与产热基因的启动子结合发挥调节作用,同时提高HDAC1蛋白的稳定性。
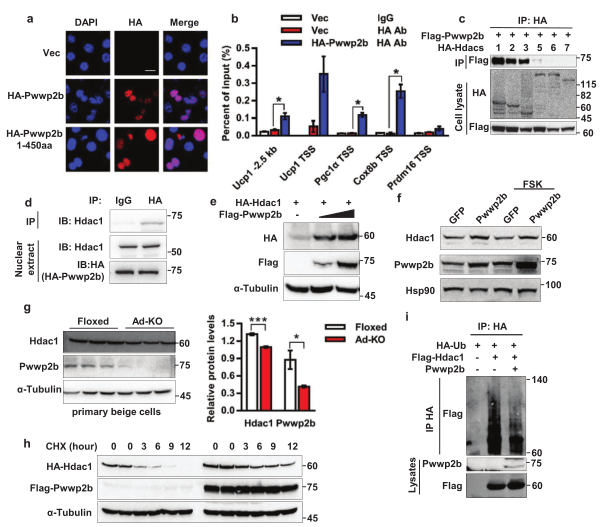
PWWP2B稳定HDAC1
6. PWWP2B调节Ucp1启动子上组蛋白乙酰化水平
为了证明PWWP2B调控产热基因是否与HDAC有关,研究人员发现HDAC1的化学抑制剂消除了PWWP2B对Ucp1和Cox8b表达的抑制作用(图6a,6b),也减少HDAC1与Ucp1和PGC1α的结合 (图6c)。PWWP2B敲除细胞中,Ucp1启动子上的乙酰化H3K27和H4水平增加(图6d,6e),HDAC1对Ucp1表达的抑制作用降低(图6g)。PWWP2B敲除小鼠中,Ucp1启动子区H4乙酰化水平升高(图6f)。综上,PWWP2B和HDAC1在产热脂肪细胞中的功能是相互联系和相互依赖的。
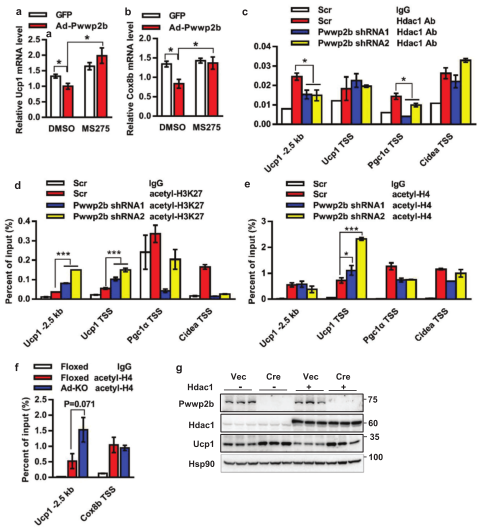
PWWP2B抑制产热基因表达需要HDAC1
7. PWWP2B调节脂肪细胞产热的模型建立
PWWP2B在NuRD亚复合体中联合并稳定HDAC1/2,以促进产热基因启动子上的脱乙酰化,作为抑制过度活跃产热的分子制动器。在没有PWWP2B的情况下,较少的HDAC1/2粘附在启动子上,微妙地激活脂肪细胞中的产热程序。
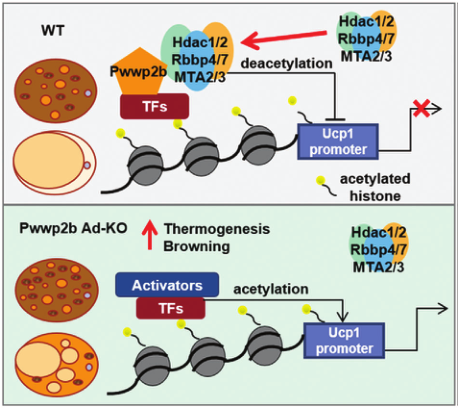
PWWP2B调节脂肪细胞产热的模型
小结
本研究构建PWWP2B基因敲除小鼠和细胞模型,揭示了PWWP2B在棕色/米色脂肪组织中通过招募并稳定组蛋白去乙酰化酶HDAC1/2,负向调控脂肪组织产热的分子机制。尽管PWWP2B被证实对脂肪组织产热功能实施负调控作用,但PWWP2B在棕色脂肪组织中表达水平显著高于白色脂肪组织,且寒冷刺激和交感神经兴奋可以进一步诱导PWWP2B的表达,表明PWWP2B是棕色脂肪细胞内在的产热反应制动装置,可有效避免棕色和米色脂肪细胞产热功能的过度激活。本研究为以组蛋白去乙酰化酶复合物为靶点,治疗肥胖、糖尿病等代谢性疾病提供新的思路。
中科优品推荐
乙酰化修饰作为生物体内广泛存在的保守的翻译后修饰之一,在代谢调控、信号转导等方面发挥了非常重要的作用。中科新生命不仅提供常规乙酰化修饰蛋白组学服务,还提供乙酰化+代谢联合分析、4D-乙酰化修饰蛋白质组学技术服务。欢迎感兴趣的老师前来咨询。
