癫痫(Epilepsy)是一种慢性中枢神经系统疾病,影响到全球大约5000万人。癫痫发作是由于大脑神经元突发性异常同步化放电,导致正常脑功能中断,临床表症为反复不自主发作,身体某一部位或整个身体短暂非自主性抽搐,有时伴有意识丧失和尿便失禁。
目前,临床上多采用抗癫痫药物控制癫痫发作,然而有近1/3的癫痫患者症状难以被抗癫痫药物控制,且药物难治率在以海马、杏仁核等区域起源的颞叶癫痫(temporal lobe epilepsy,TLE)中甚至可达70%。TLE发作机制复杂,近年来,越来越多的观点认为癫痫发作是关键脑区的功能异常导致神经环路水平上“兴奋-抑制”失衡的结果,因此解析TLE中精准环路机制对治疗癫痫至关重要。
2022年8月25日,浙江中医药大学陈忠教授团队在Nature Communications杂志在线发表了题为“Discrete Subicular Circuits Control Generalization of Hippocampal Seizures”的研究论文,研究首次揭示了海马下托(Subiculum, Sub)存在结构和功能异质性的神经亚群,Sub深层谷氨酸能神经元投射到丘脑前核(anterior nucleus of thalamus, ANT)的神经环路参与TLE发展,其通过SUB-ANT中超极化激活的阳离子门控通道(HCN)介导的簇状放电增强了TLE的形成和泛化。该研究找到了一条特异性介导颞叶癫痫发作的神经环路,为临床精准治疗癫痫发作及其干预分子靶点提供了强有力的实验依据。

结果
01 Sub锥体神经元双向调控海马癫痫发作
首先,研究者借助钙离子成像技术观察海马癫痫发作时锥体神经元的功能变化,将AAV- CaMKIIα-Gcamp6s病毒注射于海马下托(Subiculum, Sub),并埋入光纤。发现在局灶性癫痫发作(focal seizure, FS)和继发全身性癫痫发作(Secondary generalized seizure, sGS)期间海马下托锥体神经元活动增加(图1a-c)。c-Fos结果显示,大部分被激活的神经元为谷氨酸能神经元,且激活的模式存在下托亚区特异性,主要集中在下托的深层(图1f,g)。
随后,研究者将AAV-CaMKIIα-hChR2-EYFP和AAV-CaMKIIα-ArchT-EGFP分别注射于WT小鼠海马下托区(图1h),在电点燃癫痫发作模型中,光遗传激活下托锥体神经元促进了癫痫行为发作等级、延长后放电时程(after-discharge durations, ADD)并减少了到达sGS所需电刺激次数;抑制下托锥体神经元则减弱癫痫发作并缩短ADD,且增加了达到FS和sGS所需的电刺激次数(图1i-k)。提示了下托锥体神经元对海马癫痫发作具有双向调控作用。
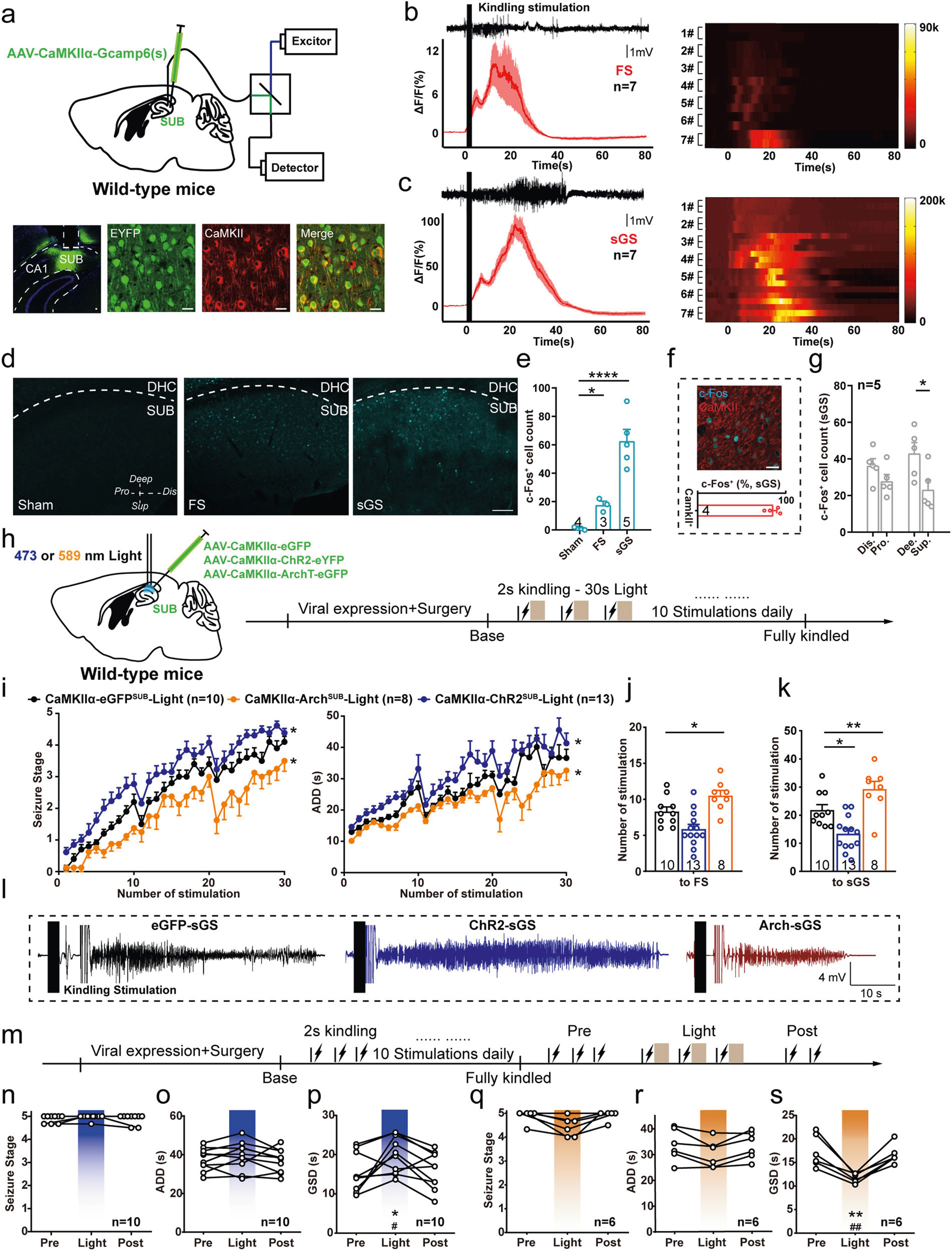
图1 Sub锥体神经元双向调控海马癫痫发作
02 SUB-ANT谷氨酸能投射环路双向调控颞叶癫痫发作
进一步,借助病毒载体示踪技术及c-Fos染色发现,下托的谷氨酸神经元向丘脑前核(anterior nucleus of thalamus, ANT)投射,为验证该通路在海马癫痫发作过程中的作用,研究者在小鼠SUB区注射AAV-CaMKIIα-hChR2-EYFP,并在ANT埋入光纤(图2a)。发现光遗传激活SUB-ANT投射通路可促进海马癫痫发作等级并延长完全点燃状态下sGS的后放电时程和总时长(图2b-f)。此外,借助光遗传学抑制SUB-ANT投射通路可延缓海马癫痫发作等级,缩短sGS的ADD和全面性发作时长(GSD)(图2i-n),这些结果提示了,海马下托的谷氨酸神经元向丘脑前核的投射通路双向调控颞叶癫痫的发作。

图2 Sub谷氨酸神经元向ANT的投射通路双向调控颞叶癫痫发作
03 SUB-ANT和SUB-EC环路对海马癫痫发作产生相反的作用
研究者继续对Sub其他下游投射区域(EC:entorhinal cortex 内嗅皮层, NAc:nucleus accumbens 伏隔核, MMB:mammillary bodies 乳头体)进行研究,借助光遗传学技术发现,抑制SUB-EC投射通路时可促进海马癫痫发作(图3)。

图3 SUB-EC、SUB-MMB和SUB-NAc环路在癫痫发作中发挥不同的作用
接下来,研究者通过向WT小鼠海马CA1注射海人酸(Kainic acid, KA)诱导慢性自发颞叶癫痫模型做进一步验证,作者将AAV-CaMKIIα-hM4Di-mcherry注射小鼠海马下托,并在ANT或EC埋入套管以精准给予CNO药物(图4a,b)。发现借助化学遗传学抑制Sub-ANT通路可缓解癫痫发作;而抑制Sub-EC通路则促进癫痫发作。
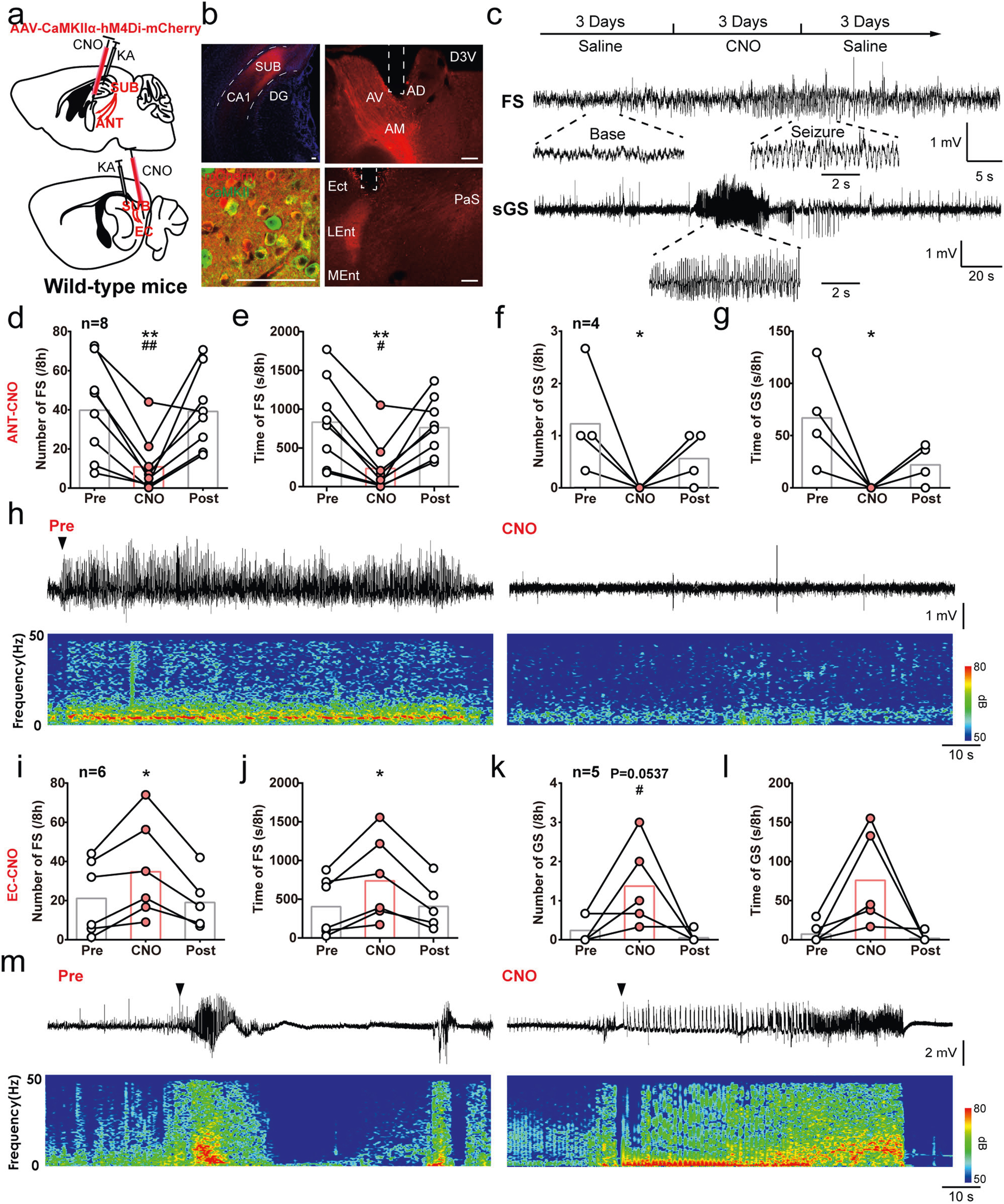
图4 SUB-ANT和SUB-EC环路在KA诱导慢性TLE发作中产生相反的作用
基于上述结果,研究者借助逆标染料标记发现Sub深层的谷氨酸能神经元投射到ANT;Sub浅层的谷氨酸能神经元投射到EC(图5a-d)。随后,通过特异在谷氨酸能神经元轴突末端表达GCaMP6元件发现,在FSs和sGSs期间,Sub-ANT的钙信号强度增加;Sub-EC的钙信号荧光强度减弱(sGSs期间先短暂增加后降低),提示了海马下托两个不同的锥体神经元亚群通过不同的投射模式对海马癫痫发作发挥相反的作用(图5e-n)。
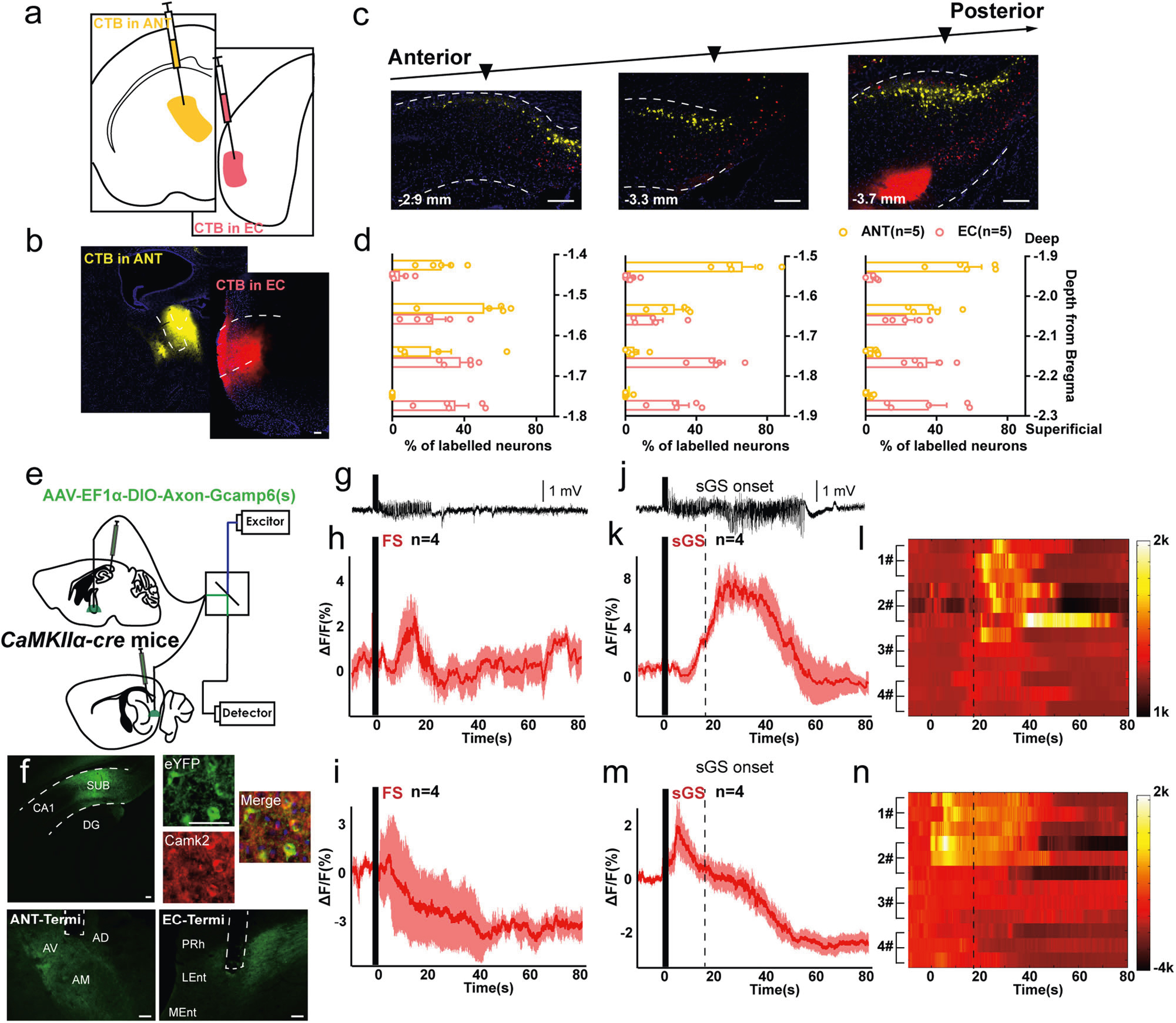
图5 SUB-ANT和SUB-EC环路对海马癫痫发作产生相反的作用
04 SUB-ANT中HCN通过调控突触可塑性促进海马癫痫发作
通过电生理记录发现,投射到ANT的Sub谷氨酸能神经元存在超极化激活环核苷酸门控阳离子(hyperpolarization-activated cyclic nucleotide-gated cation, HCN)通道功能和更强的神经元簇状放电能力,阻断HCN通道在点燃模型中可显著缓解癫痫发作等级(图6a,b)。
HCN1亚型是啮齿类动物下托中表达最丰富的一种HCN通道亚型,因此作者研究了选择性敲除投射到ANT或EC的Sub锥体神经元中HCN1是否会影响神经元放电及海马癫痫发作,将Cav2-Cre注射到WT小鼠ANT或EC中,AAV-EF1α-DIO-miR30shRNA(Hcn1)-mCherry注射到Sub区(图6c),发现在海马电点燃癫痫发作模型中,选择性下调Sub-ANT神经元中HCN1的表达可缓解癫痫发作(图6)。进一步研究发现,SUB-ANT中HCN通道通过调控突触可塑性促进海马癫痫发生。这些结果提示了SUB-ANT存在HCN通道促进的簇状放电能力,从而增强了颞叶癫痫的形成和泛化。

图6 SUB-ANT中HCN通道通过调控突触可塑性促进海马癫痫发生
结论
本文利用经典的小鼠颞叶癫痫模型,配合钙离子成像、光遗传技术、化学遗传学技术、病毒示踪技术、电生理记录等多种技术手段首次证明了海马下托存在结构和功能异质性的神经亚群,不同亚区的神经元通过不同的投射下游对颞叶癫痫中的“兴奋-抑制”平衡调控产生差异化(甚至相反)的作用,其中Sub深层谷氨酸能神经元投射到ANT的神经环路参与海马癫痫发作,进一步研究发现SUB-ANT中HCN介导的簇状放电增强了癫痫的形成和泛化。该研究找到了一条特异性介导颞叶癫痫发作的神经环路,为临床精准治疗癫痫发作及其干预分子靶点提供了强有力的实验依据。
该研究的第一作者为浙江中医药大学药学院博士后费凡,浙江大学的硕士研究生王霞及浙江中医药大学中医药科学院的徐层林研究员为共同第一作者。陈忠教授、汪仪研究员和徐层林研究员为本文的共同通讯作者。研究受到了国家自然科学基金重点项目、国家自然科学基金优青项目、浙江省自然科学基金重大项目等的资助。
和元生物有幸为研究者提供实验中使用的AAV载体,助力神经科学研究!
| AAV2/9-CaMKIIα-GCaMP6(s) | AAV2/8-CaMKIIα-hChR2-eYFP |
| AAV2/9-CaMKIIα-ArchT-eGFP | AAV2/9-CaMKIIα-eGFP |
| AAV2/9-CaMKIIα-hM4Di-mCherry | AAV2/9-CaMKIIα-mCherry |
| AAV2/9-EF1α-DIO-miR30shRNA (Hcn1)-mCherry | |
